首頁故事
抑制腸道慢性發炎 清華大學攜手國衛院研發新藥【2025.01.15秘書處】
愈來愈多現代人因壓力引發腸道慢性發炎,長期受腹瀉、消化不良所苦。本校生醫學院邱于芯助理教授與國衛院生技藥研所謝興邦所長組成生物、化學跨領域研究團隊,找到關閉腸道細胞表面離子通道的機制,成功研發出抑制發炎分子釋放的藥物,為患者帶來治療新希望。這項創新研究成果最近登上知名國際期刊《先進科學》(Advanced Science)。
現代人因情緒緊張、飲食不正常等因素,導致慢性腸道發炎病患人數逐年攀升。根據健保署統計,2022年潰瘍性結腸炎盛行率增加到10萬分之19.6;克隆氏症盛行率則約10萬分之8.3。患者長期受到腹痛、腹瀉、血便等症狀困擾,嚴重時甚至會造成腸道穿孔。
邱于芯助理教授指出,發炎性腸道疾病是一種免疫失調,成因迄今不明,也無法根治,目前臨床上多半靠消炎藥、類固醇控制,且容易復發。近來雖有新型抑制免疫的生物製劑問世,但治療費用昂貴,許多患者無法長期負擔,並將增加健保支出。
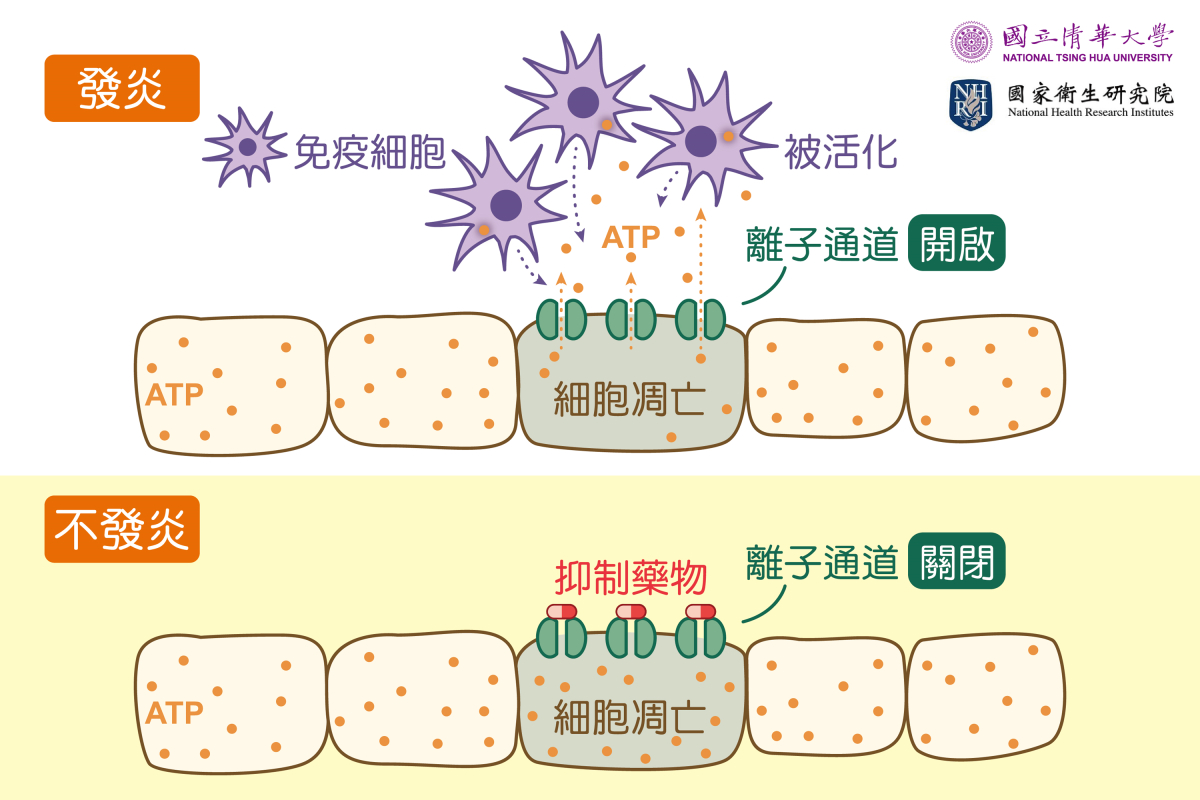
本校與國衛院共同組成的研究團隊則另闢蹊徑,研發出新型的小分子藥物,它可以阻止腸道表面黏膜細胞的離子通道打開,令發炎分子跑不出來,成功抑制發炎反應。
邱于芯助理教授說明,細胞內有一種稱為ATP的重要能量分子,當腸道細胞受損凋亡時,就會通過大孔徑的PANX1離子通道跑出來,釋放出危險的訊號,吸引免疫細胞過來清理受損的細胞。
這原本是身體清除受損細胞的修復機制。但在發炎性腸道疾病中,這個離子通道持續開啟,不斷釋放ATP,卻導致越來越多的免疫細胞被召集到腸道,引發炎症,形成惡性循環,最終造成更嚴重的腸道傷害。
這也讓邱于芯助理教授想到,如果能關閉離子通道、不讓引發反覆發炎的分子跑出來,就能關上「潘朵拉的盒子」,為治療慢性腸道發炎提供解方。
邱于芯助理教授10年前與澳洲研究團隊合作時,曾研發出一款能關閉PANX1離子通道的藥物,但當時發現的藥物有肝毒性的副作用。此次透過本校與國衛院的雙邊合作計畫,與專精藥物化學的國衛院特聘研究員謝興邦與研究員李靜琪合作,成功改良了舊藥的分子結構,效果更好,也解決了肝毒性的問題。
謝興邦所長是本校校友,畢業自清華化學系及化學所,也是本校化學系合聘教授。他表示,開發新藥就像為鎖具打造一把對的鑰匙。他領導的研究團隊透過化學修飾,在藥物分子結構中增加一個碳原子的距離,加大空間以供立體旋轉,改變了會造成肝毒性的平面結構,且藥效更好。
邱于芯助理教授說明,新藥的重要突破在於僅專一作用於關閉離子通道蛋白,而不會影響到其他的蛋白質,因此,效果好又安全。
邱于芯助理教授進一步指出,研發出關閉PANX1離子通道的新藥,就像掌握了一把控制細胞發炎的新鑰匙,未來還將繼續研發治療其他發炎性疾病的新藥,如腦中風、癲癇、慢性疼痛、氣喘、過敏,甚至心臟衰竭等,可望為組織損傷、免疫相關疾病帶來新的治療契機。
這項研究歷時近3年,本校化學系博士生薛雯勻負責新藥的化學合成與改良;生技所碩士生吳苡伶進行藥物活性檢測,從1百多種化合物中篩選出64個,再進行深入研究。本校生醫學院呂平江教授則運用電腦模擬技術,驗證了藥物與蛋白質的作用機制。
研究團隊也特別感謝台大新竹分院翁孟慈醫師與台大醫院魏淑鉁醫師,協助進行動物實驗,證實新藥能有效改善腸道發炎、血便等症狀;及澳洲樂卓博大學普恩教授(Ivan Poon)團隊的研究合作。
-
抗氧化劑一向被認為是保護細胞、維持健康的重要角色,但本校生命科學系王雯靜教授研究團隊最新發現... (繼續閱讀)
-
本校11月19日召開校務發展諮詢委員會,首度聚焦「清華十大亮點研究」,並探討桃園、高雄、中華校區... (繼續閱讀)
-
本校11月17日舉辦「諾貝爾大師在清華」系列活動首場講座,邀請2011年諾貝爾和平獎得主塔瓦庫&middo... (繼續閱讀)
-
韓國三大報之一《朝鮮日報》(The Chosun Daily)近日以台灣逆轉人才外流為主題,報導台灣如何透過... (繼續閱讀)
-
本校竹師教育學院大樓21日正式啟用。7系、3所與1個學士班、近兩千名師生自南大校區遷入光復校區,... (繼續閱讀)
-
本校與新竹10所高中共同啟動「新竹學」探究與實作課程,課程涵蓋塹城學、竹科學、流域學、客庄學、... (繼續閱讀)